八、AAV 的病理生理机制
1.ANCA 的产生:目前尚不清楚为什么会产生针对中性粒细胞自身抗原的自身抗体,因为 MPO 和 PR3 都是从免疫系统的原始颗粒中分离出来的,并且在组织损伤部位的中性粒细胞脱颗粒后,会被特异性抑制剂(α1-抗胰蛋白酶 [PR3] 和铜蓝蛋白 [MPO])迅速消除。
中性粒细胞凋亡缺陷,或凋亡细胞碎片的清除受损,可能导致这些抗原长期暴露于免疫系统。感染通过分子模拟可能也起到一定作用。在分子模拟中,微生物抗原与中性粒细胞抗原交叉反应,或可能通过产生针对互补肽的抗体和随后宿主对这些抗补体 PR3 抗体的免疫反应。
2.ANCA 的作用:临床和实验数据证实 ANCA 不仅仅是 AAV 的生物标志物,还在致病机制方面发挥重要作用。这在一系列使用抗 MPO-新月体肾小球肾炎(GN)被动转移模型的实验中首次被证明。用小鼠 MPO 免疫 MPO 缺陷的小鼠可产生高低度的抗 MPO 抗体,当这些抗体被注射到野生型小鼠体内时,动物发生了新月体性 GN 和肺出血。值得注意的是,中性粒细胞耗竭消除了这些小鼠的疾病,证实了中性粒细胞的中心作用。
在第二个动物模型中,用人 MPO 免疫 WKY 大鼠产生了 MPO-ANCA 和坏死性肾脏和肺部血管炎。曾经报道过一个病例:抗 MPO 抗体经胎盘从母体转移到胎儿,随后这个 33 周早产的新生儿出现肺出血和 GN。建立 PR3-ANCA 血管炎动物模型的尝试尚未成功。这是由于人体和实验动物的 PR3 在生物学上的差异造成的。
3. 中性粒细胞启动和活化:中性粒细胞是血管损伤的主要介导者。在感染或炎症的应答中,中性粒细胞暴露于炎性细胞因子(肿瘤坏死因子 TNF-α和白介素 IL-1),脂多糖或补体 C5a 通过 MPO 和 PR3 从原始颗粒向中性粒细胞表面移动而启动活化。在这种启动状态下,ANCAs 可能在细胞表面与这些自身抗原结合的导致强大的细胞激活。活化的中性粒细胞改变了粘附分子的表达,并与血管内皮结合。中性粒细胞脱颗粒导致了活性氧自由基和蛋白酶的释放,介导了组织损伤。
活化的中性粒细胞同样也经历了特定形式的细胞死亡(NETosis),在这个过程中,中性粒细胞胞外陷阱(NETs)从染色质网中含有 MPO、PR3 和补体成分的细胞中挤出。NETs 可以直接导致内皮细胞损伤,将 MPO/PR3 转移到血管内皮和树突状细胞进行抗原提呈,激活补体替代途径。趋化因子和 PR3、MPO 在组织里的沉积导致了自身反应性 T 细胞和单核细胞在组织损伤部位的募集。
4. 补体的作用:从组织学上看,补体在 AAV 中的作用有限,因为肾活检中补体沉积少,而且没有低补体血症。最近来自各种补体缺乏的抗 MPO 小鼠模型的证据已经证明了补体的替代途径的作用,特别是过敏性毒素 C5a 和 C5a 受体(CD88)似乎是这个过程的中心。提出了一种放大回路的假设:这其中活化的中性粒细胞释放 properdin,促进补体替代途径,并产生过敏性毒素 C5a,C5a 与中性粒细胞 C5a 受体相结合,导致中性粒细胞进一步启动和活化。
最近对人类的研究也支持这些发现,证明了循环中的替代途径激活和替代途径补体成分的组织沉积更为普遍。活动性 AAV 患者的血循环和尿液中 C5a 水平升高,循环中 C3 水平降低(5%-20%)与预后差有关。最令人兴奋的是,早期临床研究使用 C5a 受体拮抗剂 avacopan 支持 C5a 在 AAV 中的重要作用。
九、AAV 的肾脏病理表现
ANCA 相关性 GN 的病理特征是坏死性和/或新月体 GN,通过免疫荧光或电子显微镜不能检测到明显的免疫复合物沉积(图-1)。
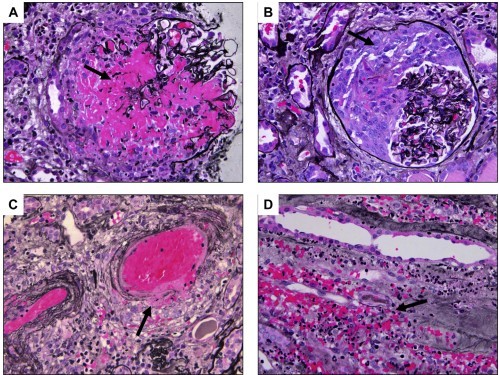
图-1 肾活检病理:光镜显示典型的坏死性新月体性肾小球肾炎的特征。A:节段性坏死的肾小球(箭头处)。B:大的肾小球新月体(箭头处)填满了大部分包曼氏囊,压迫肾小球簇。C:较少见的表现:坏死性肾小球外血管炎(箭头处)。D:更罕见:髓质脉管炎(箭头处)伴明显中性粒细胞。
十、AAV 的临床特点 表-1 两种不同 AAV 的临床特点比较
PR3-ANCA | MPO-ANCA | |
人口学特点 | 50-70 岁 | 60-80 岁(平均年龄较 PR3-ANCA 大 10 岁) |
地理分布 | 欧洲北部,北美洲 | 欧洲南部,亚洲 |
遗传风险位点 | HLA-DP,PRTN3,SERPINA1 | HLA-DQ |
病理特征 | 坏死性血管炎,肉芽肿性炎症 | 坏死性血管炎,无肉芽肿性炎症 |
肾脏 | 更多急性表现 | 更常见,活检中慢性损伤更多,可能是一个缓慢的病程,更多是肾脏局限受累,孤立性间质性肾病(罕见),通常是 MPO-ANCA。 |
呼吸道受累 | 更常见;结节、空洞和中心气道疾病更多是 PR3 特异性。 | 较少见,可能是慢性肺纤维化,外周网状、蜂窝状和普通的间质性肺炎更多是 MPO 特异性 |
上气道疾病 | 更常见,破坏性病变(鼻穿孔、鞍鼻) | 罕见 |
结局 | 产生对疾病抵抗性的可能更多 | 长期生存率更差(更多慢性损伤) |
复发率 | 较高 | 较低 |
治疗 | 对利妥昔单抗的治疗反应优于对环磷酰胺的治疗反应 | 对利妥昔单抗和环磷酰胺的治疗反应相似 |
EGPA 类似于 GPA,因为它也是以肉芽肿性炎症和坏死性血管炎为病理特征,累及中小血管,但与 GPA 的区别在于嗜酸性粒细胞增多症和哮喘。ANCA 阳性仅见于 50%EGPA 患者,典型的是 MPO-ANCA。肾脏受累仅发生在 20% 的 EGPA 患者,但仅仅只有 ANCA 阳性组会发生坏死性新月体性 GN。
1.AAV 中的肾脏受累:肾脏疾病在 AAV 中很常见,并且是死亡率最重要的预测因子。肾小球滤过率(GFRs)<50 ml/min 的患者在 5 年时有 50% 死亡或肾衰竭的风险。典型的肾脏表现是快速进展的肾小球肾炎伴肾功能减退、亚肾病范围的蛋白尿、显微镜下血尿和高血压,持续数天到几个月。
肾活检典型表现为寡免疫复合物局灶坏死性新月体 GN。在 MPO-ANCA 患者中,病程可能更长,其特点是不可逆肾损伤(肾小球硬化和间质纤维化)和对免疫抑制治疗反应较差。虽然坏死性新月体 GN 典型的是寡免疫复合物的,但在超过 50% 的活检中发现免疫复合物沉积的证据,并且与较高水平的蛋白尿和较高比例的肾小球新月体相关。肉芽肿性炎症表现为肾脏肿块是 GPA 的一种罕见表现。
无论起病时 GFR 水平如何,及时治疗对于阻止肾脏病进展至肾衰竭都很重要。肾脏病缓解被定义为 Scr 水平稳定或改善和血尿缓解。蛋白尿可以出现在缓解期,反映了血管炎的结构损伤。年龄、MPO-ANCA、低 GFR、低正常肾小球比例和高度肾小管萎缩,均与较差的结局相关。肾血管炎复发是肾衰竭的另一个重要预测因素,在缺乏可靠的肾脏复发生物标记物的情况下,密切监测 Scr 水平的升高和血尿的复发,仍然是 AAV 患者长期治疗的一个组成部分。
监测 ANCA 水平变化在预测疾病复发方面的价值还有争议。在基线便有肾脏受累的患者中,ANCA 水平增加被证实能预测复发。考虑到巨噬细胞和 T 细胞的致病作用,尿液中这些细胞激活的生物标志物可能可以预测疾病的活动性。巨噬细胞来源的尿可溶性 CD163、血清和尿液 CD25 水平最近被证明可以预测肾脏血管炎的复发。
2.AAV 的全身特点:疲乏、肌痛和发热等症状比较突出,可能在起病前几个月就出现。在 GPA 中肺更常累及,肺坏死性肉芽肿性损害可产生 CT 上可见的空洞或结节性病变。上呼吸道疾病可表现为鼻炎、鼻窦炎、中耳炎或肉芽肿性炎症,导致鼻中隔穿孔和鼻腔塌陷。在 MPA 中,上呼吸道受累较少见,而且 MPA 中肺受累典型表现为肺泡出血并且可能与肺纤维化有关。
也可能发生听力丧失或巩膜炎/葡萄膜炎。常见下肢紫癜,常继发于白细胞破碎性血管炎。皮肤结节性病变可见于 GPA。周围神经病变(典型的是多发性单神经炎)可以发生,但中枢神经系统受累是罕见的。肠系膜血管炎可表现为腹痛和便血。肝脏或胰腺的血管炎可以模拟肝炎或胰腺炎,但十分罕见。表现为心肌炎或心脏传导阻滞的心肌受累很罕见。静脉血栓形成可发生在血管炎的活动期,并可能与抗血浆原抗体有关。
十一、其它形式的血管炎
1. 药物诱导的血管炎:许多药物都与小血管炎相关,包括:肼苯哒嗪、丙基硫氧嘧啶、二甲胺四环素和抗肿瘤坏死因子等。药物诱导的血管炎通常表现为高滴度的 MPO-ANCA 和其它自身抗体,如抗核抗体 ANA。肼苯哒嗪相关的血管炎可以很严重,容易累及肾脏。掺有左旋咪唑的可卡因能引起一种不同类型的 ANCA 血管炎,其临床特征除了主要脏器的血管炎外,还有皮肤明显坏死,PR3-ANCA 和 MPO-ANCA 在血清学上呈双重阳性。
2.ANCA 和抗 GBM 抗体双阳性的血管炎:新月体 GN 的一组亚组患者会有 ANCAs 和抗 GBM 抗体的双重阳性。ANCA 和抗 GBM 抗体的共表达频率高于偶然发生的预期。抗 GBM 病患者中有 10%-40% 的人 ANCA 检测阳性,几乎完全都是 MPO。AAV 患者中有 5%-14% 循环中有抗 GBM 抗体。
两者之间的联系是推测性的,尽管已经证明 ANCAs 可能是首先被发现的,ANCAs 诱导的肾小球炎症可能暴露 GBM 中的隔离表位,从而触发抗 GBM 抗体。临床上,这些病人在就诊时有严重的疾病,早期发病率和死亡率与抗 GBM 病相似,而他们的长期病程特点是与 AAV 患者相似的疾病复发。
(未完待续)
